메디컬 데이터에서 많이 사용되는 CV 기법인 segmentation에 대한 논문 리뷰를 진행해 보겠습니다.
segmentation은 딥러닝에서도 많이 다루고 있는 주제 중에 하나이지만 딥러닝 같은경우 가용되는 컴퓨터 리소스도 많을 뿐더러 많은 데이터가 필요하다는 단점이 있습니다
메디컬 데이터 측면에서 본다면 일반적인 데이터보다 라벨링이 어렵다는게 가장 큰 문제인데 메디컬 데이터는 일반적인 사람이 라베링하기가 많이 어렵기 때문에 의료인(관련 분야의 의사, 영상의학과 교수 등등)이 진행해야 합니다.
하지만 의료인과 같은 경우는 전문적인 직종일 뿐더러 인적자원이 풍부하지 않기 때문에 더더욱 어렵다는 점이 있습니다.
따라서 오늘은 보다 전통적인 방법인 Otsu을 사용하여 segmentation을 진행하는 논문에 대해 리뷰해보겠습니다.
Paper : Threshold segmentation algorithm
Threshold segmentation algorithm for automatic extraction of cerebral vessels from brain magnetic resonance angiography images -
The proposed threshold segmentation method can be used to accurately and efficiently extract cerebral vessels from brain MRA images. Threshold segmentation may be used for studies focusing on three-dimensional visualization and volumetric quantification of
pubmed.ncbi.nlm.nih.gov
해당 논문을 직접 구현한 코드도 있습니다. 한번씩 구경해주시고 코드적으로 조언해 주실 부분이 있다면 달게 받겠습니다
Github: LINK
1. Introduction
뇌 혈관 분할은 의학적 진단에서 중요한 역할을 하는데 협착 및 동맥류와 같은 혈관 이상을 진단, 정량화 및 등급화하기 위해 대뇌 혈관의 3차원 시각화를 수행하는 데 필요합니다.
이는 신경외과 수술을 계획하고 수행하는 데 도움이 된다는 필요성이 제기되었습니다. 이때 사용되는 데이터는 자기공명 혈관조영술 (MRA)이라는 기법을 통해 촬용된 데이터이며, MRA 중에서도 3D TOF MRA를 통해 진행됩니다.
뇌혈관 분할은 복잡한 기하학적 구조와 제한된 Spatial Resolution 및 이미지 대비로 인해 정확하게 분할이 어렵습니다.
뇌혈관 분할 방법론에는 크게 두 가지가 존재하는데, 이는 skeleton and non-skeleton기반의 방법들이 존재합니다.
skeleton 기반 방법론은 대체로 혈관에서 중심선을 추출하고, 이 중심선을 통해 혈관 트리를 생성하여 뇌 혈관 분할을 진행합니다. 하지만 이 방법 같은경우에는 불완전한 혈과의 체적 정보를 제공한다는 단점이 있습니다.
non-skeleton기반의 방법은 3D MRA에서 직접적으로 뇌혈관 분할을 진행하는데, 이는 대체적으로 임계값 분할방법을 사용하는데 해당 방법의 경우는 임계값이 뇌혈관 분할에 직접적인 영향이 크므로 정밀한 계산이 필요하다는 부분이 있습니다.
따라서 본 논문에서는 A threshold segmentation method was developed to extract cerebral vessels from 3-D TOF MRA images방법을 제안하였습니다.
2. Materials and methods

그림 3은 논문의 전반적인 threshold segmentation의 흐름도를 나타냅니다. 논문에서 제안된 접근 방식의 분할 프레임워크는 5단계로 구성되었습니다.
순서대로 살펴 보자면,
1단계: Otsu의 임계값 방법(Otsu, 1975)을 사용하여 MRA 이미지에서 전경 및 배경 영역을 추출했습니다. 전경 영역은 WM, GM, 눈의 일부 및 대뇌 혈관으로 구성된 뇌 조직에 해당합니다. 낮은 신호 영역은 뇌척수액, 뼈 및 배경 공기를 포함하는 배경 영역이었습니다.
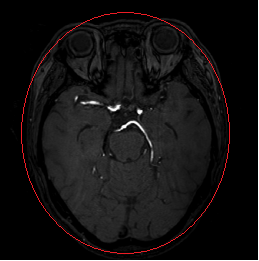
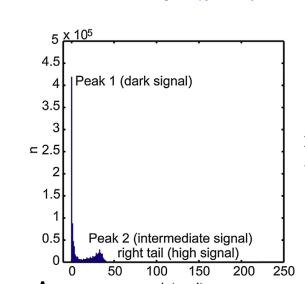
"전경 영역을 따로 분리해주는 이유는 오른쪽의 그림과 같이 많은 분포를 가지는 데이터(Peak 1)가 배경 영역에 해당하는 데 해당 부분이 뇌조직과 대뇌혈관 분리시 방해가 되기 때문에 분리를 진행하고 다음 순서로 넘어 갑니다."
"추가적으로 Peak 1은 검은색 바탕의 영역을 나타내며, Peak 2는 뇌조직과 기타 조직, 주요 분할 포인트인 대뇌혈관은 Right tail에 구성되어 있는데 분포가 많지 않아 임계값 분할시 Peak 2에 포함되기 때문에 적절한 분할이 어렵습니다"
2단계: 전경 영역에 대한 평균 및 표준 편차를 계산했습니다. 분할 효율성을 높이기 위해 전경 영역에서만 분할을 수행하여 전경 영역을 대뇌 혈관과 기타 뇌 조직의 두 부분으로 나눴습니다.
3단계: 전경 영역의 각 복셀(xi)에 대해 PDF, 즉 pNormal(xi) 및 pGumbel(xi)을 계산했습니다.
개인적인 의견으로 Gumbel과 같은경우는 극단값을 잘 표현해주는 분포 함수로써 대뇌 혈관의 시작점을 찾는데 용이하기 때문에 사용된 것으로 파악됩니다.
"pNormal(xi) 및 pGumbel(xi)의 산출식은 논문에 자세히 설명되어 있습니다.
4단계: pGumbel(xi)과 가중치를 비교하여 뇌 조직에서 대뇌 혈관을 추출하기 위한 임계값을 결정했습니다.
임계값은 그림과 같이 "pGumbel (xi) ≥ w × pNormal (xi) " = Th2 지점에서 잡았습니다.

5단계: False positive(FP) 신호가 최소화되었습니다. 하지만 주요 혈관과 연결되지 않은 불필요한 혈관 또는 인공물에 해당 하는 하나(격리된) 또는 두 개의(연결된) 복셀만큼 존재하기 때문에 분할 결과에서 FP 신호인 이러한 복셀을 제거하기 위해 dilation and erosion을 포함한 형태학적 연산을 수행했습니다. 3 × 3 크기의 컨볼루션 커널을 사용하여 형태학적 후처리를 수행했습니다.
3. Results
논문에서 제안된 임계치 분할 알고리즘을 사용하여 3차원 TOF MRA 영상에서 뇌혈관을 자동으로 추출한 결과입니다.

아래의 그림 들을 보았을 때 FP 신호는 매개변수 w가 작을 때(예: w = 2 또는 5) 분할 결과에서 상대적으로 더 많았습니다.
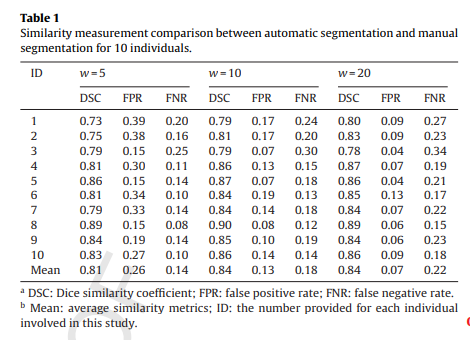
각각의 가중치 값인 w를 사용한 분할 결과 값인 DSC, FPR 및 FNR은 표 1에 요약되어 있습니다.
w의 변화로 인한 유사성 메트릭의 곡선은 그림 7에 표시되어 있습니다. 결과는 DSC가 초기에 증가했다가 w가 증가함에 따라 감소함을 보여주었습니다. w를 2에서 100으로 변경하면 FPR이 117%에서 3.21%, FNR이 8.23%에서 28.97%로 나타났습니다.
의료 영상 분할의 경우 DSC가 ≥0.7이면 자동 분할과 수동 분할이 매우 잘 일치함을 나타냅니다. 따라서 제안된 임계값 분할 알고리즘의 성능은 w의 넓은 범위(예: w ∈ [5, 100]) 내에서 수용 가능하다는 점을 알 수 있습니다.
본 논문에서 사용한 데이터로 보았을 때 실험에서 w가 "w ∈ [10, 20]"일 때 가장 좋은 성능을 보여줍니다.
마지막으로 다른 방법론들과 비교한 결과입니다.

결과적으로 보았을 때 가장 좋은 DSC를 가지지는 않지만, 런타임 측면에서 독보적으로 빠르다는 것을 볼 수 있습니다.
하지만 개인적인 의견으로는 생명을 다루는 기술로써 런타임 보다는 DSC가 가장 중요하지 않을까라는 생각을 합니다.
4. Conclusion
결론적으로 제안된 임계값 분할 방법은 뇌 MRA 영상에서 대뇌 혈관을 정확하고 효율적으로 추출하는 데 사용할 수 있습니다. 임계값 분할은 대뇌 혈관의 3차원 시각화 및 부피 정량화에 중점을 둔 연구에 사용할 수 있습니다.
추가적인 개인적 생각 본 논문에서는 Automatic라는 키워드를 썻지만 부수적인 W라는 매개변수가 존재한다는 점에서부터 이미 Automatic이 아니라고 생각합니다.
이는 W는 데이터마다 보정해줄 필요성이 있기 때문에 이는 Automatic이 아닌 Semi-automatic이 아닐까 생각해봅니다.
'Review > Paper' 카테고리의 다른 글
| Semantic Segmentation(2) - FCN (1) | 2023.05.07 |
|---|---|
| Sementic Segmentation(1) - Traditional method (0) | 2023.02.26 |
